春启新程,捷报传来!2026年3月初,海南普利制药股份有限公司(以下简称“普利制药”)布美他尼原料药正式获得国家药品监督管理局上市批准,这一里程碑式突破,不仅丰富了普利制药原料药产品矩阵,更将为国内利尿剂原料药市场注入新活力,同时为广大合作伙伴开辟高质量发展新赛道,现面向全国诚邀优质经销商、代理商携手,共享临床刚需品类的财富红利!

布美他尼原料药
布美他尼原料药作为高效、速效、低毒的强效髓袢利尿剂药用活性成分(API),是临床常用的强效利尿原料药。
布美他尼原料药化合物原研主体为第一三共,1976年其开发的布美他尼注射剂在日本获批上市,为全球首个布美他尼制剂;美国原研上市主体为Validus Pharmaceuticals(商品名Bumex),欧洲原研上市主体为Karo Pharma AB(商品名Burinex),目前原研专利已到期,全球市场以仿制药为主。本次国内获批,与美国、欧洲市场共用同一产线,同质量标准,将为国内患者提供出口品质的药品。

布美他尼原料药市场容量
布美他尼作为高效、速效、低毒的强效髓袢利尿剂,利尿强度约为呋塞米的20-40倍,临床应用场景高度集中且刚需性突出,95%以上用于心力衰竭、肝硬化、肾病综合征等所致的顽固性水肿,以及急性肺水肿、脑水肿急救,同时可用于难治性高血压、电解质紊乱等治疗,是临床不可替代的专科用药原料。当前,全球心血管疾病、慢性肾病患病率持续攀升,全球心衰患者约6400万人,我国心衰、慢性肾病患者基数分别达1370万、1.2亿,且随人口老龄化加速持续扩容,直接驱动布美他尼原料药需求稳步增长。
市场数据:全球布美他尼需求持续增长
根据最新市场数据显示,国内布美他尼原料药市场规模已达8-10亿元,年均增速7%,全球布美他尼原料API消耗量已达30吨,同比增长约 8%,市场需求持续扩大。
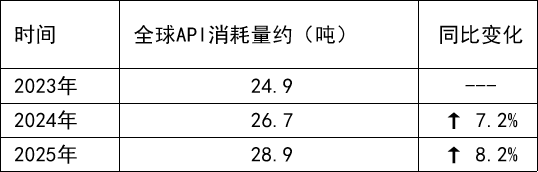
中国市场出口占比近40%,市场前景广阔且需求稳定,而普利制药此次获批的布美他尼原料药,凭借企业核心技术优势,在产品纯度、稳定性上更具竞争力,更依托公司已有的布美他尼注射液相关发明专利技术,可更好地匹配下游制剂企业需求,实现原料与制剂的协同赋能。
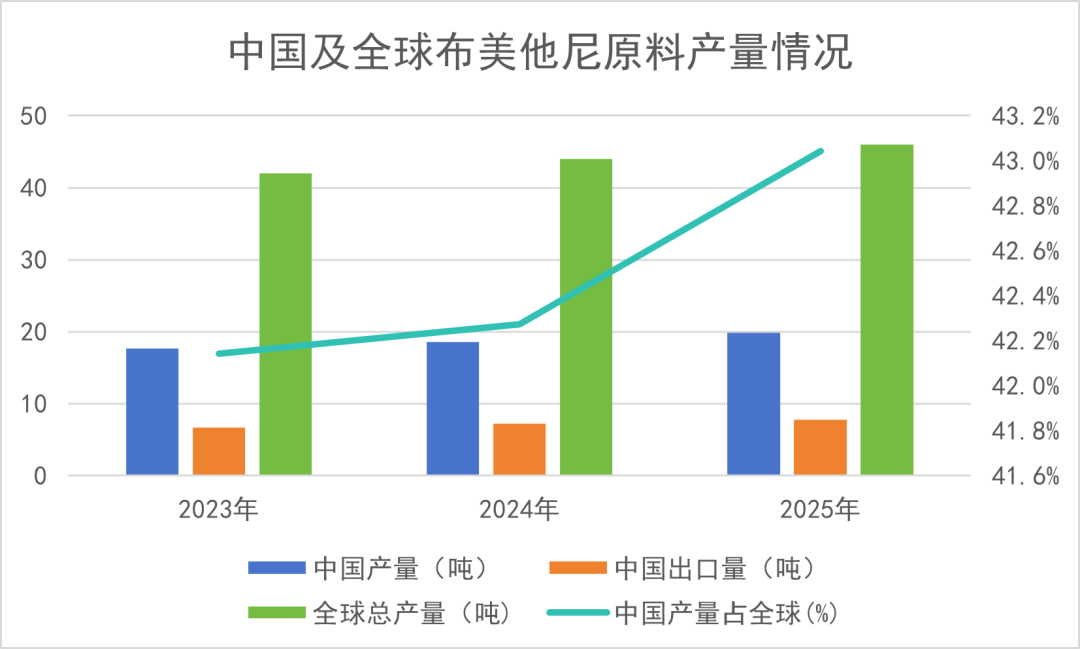
从区域消耗分布看,亚太、美国、欧洲等市场是布美他尼的核心消耗区域。其中:美国:约13吨(占比44%)、欧洲地区:约8.8吨(占比30%)、亚太:约6.3吨(占比22%);至此,海南普利布美他尼原料药已获得中国、欧盟等核心市场的准入资格,覆盖全球绝大多数主流市场。
普利制药 1992 年成立于海口,是中国医药制剂国际化先导企业和国家工信部智能制造示范企业,已被国家工信部纳入工业转型升级中国制造 2025 年儿童药重点项目企业,2023年海南普利通过海关“AEO”高级认证。
此前,海南普利及其子公司浙江普利、安徽普利也曾多次顺利通过美国FDA、欧盟EMA现场审计。作为中国医药制剂国际化先导企业,普利制药多年来一直恪守全球较高质量标准,是国内为数不多的原料药和注射剂研发和生产平台,也是为数不多的同时获得美国、中国、欧盟等药监部门批准的原料药、关键辅料、药物药剂和GMP中间体CMO/CDMO的优质供应商。

诚邀合作,欢迎垂询,国内招商:
GNXS@hnpoly.com
0571-89385059

 首页
首页